Cuando se tiene un cultivo en agar (caja petri) siempre es relevante anotar la morfología colonial (colonias aisladas) de la cepa bacteriana para facilitar la identificación.
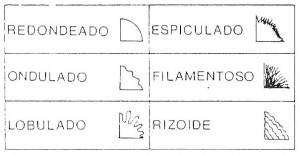
Generalmente se reporta la morfología colonial tal como uno la percibe, por ejemplo si se ve que las colonias bacterianas son como puntitos, pues reportan que son puntiformes, si son lisas pues reportan que son lisas, si observas que están como moco, pues reportan que están mucosas, si su color es amarillento pues reportan que son de color amarillento, y así sucesivamente., también puedes agregar características que consideres importante para identificarlas, por ejemplo el olor. Un ejemplo de esto dicho anteriormente se muestran el las imágenes siguientes para un mayor aprendizaje.